Trabalho de Química
Grupo: Paulo,Diogo e Wesley

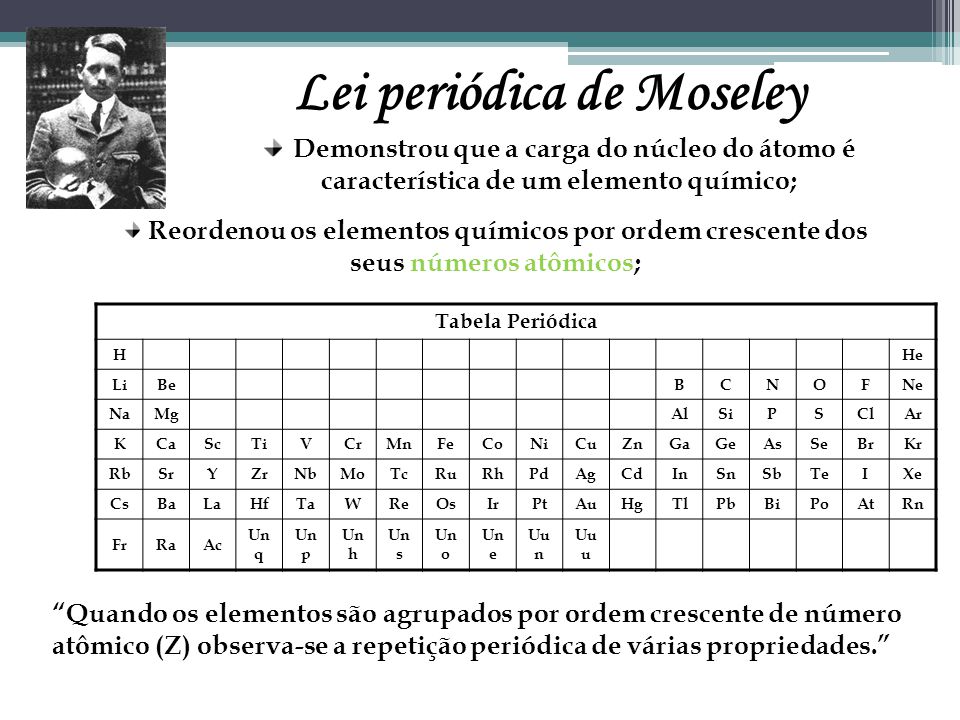
Moseley e a Tabela Periódica
Biografia
Henry Gwyn-Jeffreys Moseley, foi um importante químico e físico, que nasceu no ano de 1887, em Weimouth na Inglaterra. Foi ele quem propôs o número atômico dos átomos dos elementos. Trabalhou juntamente com Ernest Rutherford. Estudou em Oxford e tornou-se Reitor de Física na Universidade de Cambridge. Foi nesta universidade que foi colaborador de Rutherford.
Realizou estudos sobre espectroscopia de raios X. Em 1900, Moseley estudou a emissão de raios X por átomos que haviam sido bombardeados por feixe de elétrons. Concluiu que esta emissão estava ligada a um valor inteiro de cargas positivas no núcleo atômico.
Ele verificou que átomos de elementos diferentes tem diferentes números de carga positiva no núcleo. O valor desta carga é o conhecido número atômico, que caracteriza os elementos químicos.
Por volta de 1903, determinou os comprimentos de onda de radiações alfa de vários elementos e obteve uma relação entre os comprimentos de onda das radições consideradas e os números atômicos dos elementos que as emitem.
Esta descoberta de Moseley foi importante para a classificação periódica dos elementos.
Moseley mostrou a existência de lacunas que deveriam ser preenchidas na Tabela periódica. A tabela atual possui a mesma configuração da época de Moseley. Moseley morreu em um combate da Primeira Guerra Mundial, na Turquia, em 1915.
Como realizou a pesquisa
No início do século XX, quando Henry Moseley examinou o espectro de raios x dos elementos, descobriu que todos os átomos de um mesmo elemento químico apresentavam a mesma carga nuclear, e portanto, tinham o mesmo número de prótons, que consistem no número atômico do elemento. Rapidamente chegou-se à conclusão que os elementos ficariam em um padrão ainda mais regular quando arranjados em uma tabela em ordem crescente de seu número atômico, ao invés da massa atômica.
“De modo geral, à medida que o número atômico cresce, a massa atômica também cresce. Há apenas quatro casos de elementos consecutivos na tabela periódica em que o de menor número atômico apresenta maior massa atômica.
Imagem de sua tabela periódica
Comentários
Postar um comentário